En 1666 Newton descompuso la luz del Sol utilizando un prisma de vidrio. En una carta al presidente de la Royal Society le explicaba en que había consistido la experiencia:
Para cumplir la última promesa que le hice, le informaré sin más ceremonia que a principios del año 1666 me procuré un prisma de vidrio triangular para tratar el célebre fenómeno de los colores con él. Para ello oscurecí mi habitación y practiqué un pequeño agujero en el cierre de mi ventana que dejara pasar una cantidad conveniente de luz del Sol. Coloqué mi prisma a su entrada de manera que se refractara desde allí hasta la pared opuesta. Al principio fue una diversión muy placentera ver los colores vividos e intensos producidos, pero después de un rato cosiderándolos más circunspectamente, quedé sorprendido al verlos en una forma oblonga, porque de acuerdo con las leyes de refracción, hubiera esperado que tuvieran forma circular.

Ilustración de Voltaire, amigo de Newton, para explicar la descomposición de la luz por el prisma (“De Arquímedes a Einstein“, Manuel Lozano Leyva, 2005).
Joseph Fraunhofer nació en 1787 en Straubing (Baviera). Al igual que su padre se dedicó al trabajo del vidrio y la fabricación de instrumentos ópticos. En 1817, utilizando uno de sus prismas de vidrio Flint repitió el experimento de Newton, haciendo pasar un rayo solar a través de una rendija paralela a la arista del prisma. Aumentó la imagen del espectro mediante una lente y, para su sorpresa, descubrió que lo que Newton había tomado por un espectro continuo en donde los colores se fundían sin interrupción, tenía una multitud de rayas intermedias oscuras y hasta totalmente negras.
Espectro solar de Fraunhofer.
Fraunhofer llegó a situar con precisión la posición de 580 de estas rayas oscuras, distinguiendo entre ellas 8 rayas principales, para que le sirvieran de puntos de referencia y comparación. A estas rayas las designó con las primeras letras del alfabeto. Las rayas A, B y C están en el rojo (La C a poca distancia del naranja). La linea doble D está en el límite entre el naranja y el verde; E está en medio del verde; F en medio del azul; G esta entre el añil y el azul y la doble raya H al final del morado. La letra a minúscula indica un grupo de lineas en el rojo y la b minúscula en el verde.

Posteriormente, a finales del siglo XIX, Angstrom obtuvo un espectro de 3 metros de longitud y 1.600 rayas oscuras y Thollon uno de 10 metros de largo en el que se podían diferenciar 4.000 rayas oscuras. En la misma época Brewster usaba en sus experimentos, para hacer más sensibles sus ojos al estudiar el espectro solar, vapores de amoniaco cuya acción disolvente destruye el velo fluido que cubre la superficie del ojo.
Fraunhofer estudió también los espectros de los objetos que reflejaban la luz solar (La Luna, los planetas, las nubes, etc.), viendo que tenían el mismo espectro que la luz del Sol, aunque con las rayas de menor intensidad. Estudiando el espectro de otras estrellas observó que, por el contrario, no todas tenían la misma distribución de rayas oscuras.
Espectro de diferentes estrellas, que Fraunhofer clasificó en cuatro tipos (“El Mundo Físico“, Amadeo Guillemin, 1882).
El estudio de los espectros de la luz llenó el tiempo de muchos investigadores, se necesitaban fuentes de luz intensas y se probó con las velas, los fuegos de todo tipo, el hierro incandescente y muchos otros. La experiencia llevó al conocimiento de que las sustancias sólidas o líquidas incandescentes producían un espectro continuo, mientas que en los gases incandescentes el espectro era discontinuo y estaba formado por un número limitado de rayas brillantes, o fajas luminosas, separadas por anchos intervalos oscuros. Tanto en unos como en otros, al igual que pasaba en el espectro solar, las lineas brillantes o negras siempre ocupaban el mismo lugar.
Para estudiar los espectros de los elementos simples, se introducía en la llama un hilo de platino impregnado de una solución salina de estos elementos. El agua empezaba por evaporarse, la sal en disolución se evaporaba a su vez, viéndose parecer en el espectro las rayas características del metal. Para estudiar el sodio se utilizaba sal marina, produciéndose un espectro con una raya amarilla de gran intensidad. El litio da dos rayas principales, una amarilla de escaso brillo y otra roja y brillante; el potasio dos lineas características, una roja y otra violada, acompañadas de algunas amarillas y verdes; el calcio una verde muy viva, otra anaranjada y otra azul; el bario dos verdes y otras en el amarillo y el azul; el talio, una sola, de color verde y notable por su brillo. Basta la millonésima parte de un miligramo de sodio para que aparezca la raya marilla característica del espectro de este metal.
Dos químicos y físicos alemanes, los señores Kirchhoff y Bunsen, consiguieron que el análisis espectral alcanzara un alto grado de precisión desde sus comienzos. «Preparo, dice Bunsen, una mezcla de los cloruros de los metales alcalinos y alcalino-térreos, sodio, potasio, litio, bario, estroncio y calcio, que contenga á lo sumo una cienmilésima de miligramo de cada una de estas sustancias; aplico esta mezcla á la llama, y observo el resultado. Primeramente aparece la línea amarilla intensa del sodio en el fondo de un espectro continuo muy pálido; cuando empieza á ser menos perceptible y se ha volatilizado ya la sal marina, se presentan las tenues líneas del potasio, seguidas de la línea roja del litio, que desaparece en breve, mientras que las verdes del bario brillan con toda su intensidad. Entonces quedan totalmente volatilizadas las sales de potasio, litio y bario; al poco rato se muestran las líneas del calcio y del estroncio como si se disipara un velo, y adquieren paulatinamente su forma y brillo característicos.»
Por medio del análisis espectral, se comprueba fácilmente la presencia del sodio en el aire y en las partículas de polvo que tiene en suspensión. La sensibilidad de reacción de este metal es tan grande, que los observadores del espectroscopio han de tomar toda clase de precauciones para que esta reacción no se manifieste al punto mediante la presencia de la raya amarilla en el espectro, bastando sacudir el polvo de un libro cerca del instrumento para que en el acto aparezca dicha raya.
Cuando Bunsen concentró agua mineral, reduciendo treinta toneladas a unos pocos litros, vio, entre las líneas de muchos otros elementos, dos sorprendentes líneas azules, juntas, que nunca había visto antes. Le pareció que eso era la firma de un nuevo elemento. «Lo llamaré cesio a causa del hermoso azul de su línea espectral», escribió, y anunció su descubrimiento en noviembre de 1860.
Con este método se descubrieron, en aquella época, seis nuevos metales; los dos primeros, el cesio y el rubidio, por Bunsen y Kirchhoff; el talio, por Crookes y Larny; el indio por Reich y Richter; el galio, por Lecoq de Boisbaudran y el escandio por Nilson. El nombre de cesio se le ha aplicado por sus dos rayas azules; el de rubidio por las rayas rojas que caracterizan su espectro; el de talio recuerda la raya verde característica de este metal, y el de indio, una raya azul situada en el añil. El galio y el escandio (procedentes de los nombres de Francia y de Escandinavia, patrias de los descubridores) tienen, el primero dos rayas en el morado, y el segundo un crecido número de líneas, particularmente en el amarillo.
En la segunda mitad del siglo XIX se descubrieron unos veinte elementos más con ayuda del espectroscopio: el indio y el talio (que también recibieron su nombre de las líneas espectrales de brillante color), el galio, el escandio y el germanio (los tres elementos que Mendeléiev había predicho), todas las tierras raras que quedaban y en la década de 1890 todos los gases inertes
 Espectro del helio (“El tío Tungsteno“, Oliver Sacks, 2003).
Espectro del helio (“El tío Tungsteno“, Oliver Sacks, 2003). La espectroscopia también permitió el descubrimiento del helio. Lockyer, durante un eclipse solar, en 1868, consiguió ver una línea amarillo brillante en la corona del sol, una línea próxima a las líneas amarillas del sodio, pero claramente distinta. Conjeturó que esa nueva línea debía de pertenecer a un elemento desconocido en la tierra, y lo llamó helio (le dio el sufijo metálico de -ium porque supuso que era un metal).
Representación del espectro de la luz solar (I) y del de los elementos potasio (II), sodio (III), cesio (IV) y rubidio (V). Estos dos últimos elementos fueron descubiertos por Bunsen y Kirchhoff mediante el análisis de sus espectros.
Situando la llama de un mechero de gas delante del anteojo del espectroscopio, y amortiguándola hasta el punto de que quede reducida a una llama azulada casi imperceptible, no da espectro: detrás del prisma reina completa oscuridad. Pero si introducimos en la llama una sal metálica, por ejemplo, un poco de sal marina, aparecerá la raya amarilla del sodio.
Si se da paso á un rayo de Sol al propio tiempo y en el mismo prisma, de modo que el espectro del sodio y el solar se sobrepongan, se notará una coincidencia perfecta en la posición de la raya amarilla del sodio y de la doble raya oscura D de Frauenhofer.
Si se sustituye la luz del Sol por la conocida con el nombre de luz de Drummond (Que se obtiene quemando un fragmento de cal en una llama de gas atravesada por una corriente de oxígeno) el espectro de esta luz, visto aislado, presenta notable esplendor y perfecta continuidad, y no contiene ninguna de las líneas oscuras del solar. Pero si se procede de modo que cubra exactamente el espectro del sodio, interponiendo la luz Drummond entre el prisma y la llama de dicho metal, desaparece en el acto la línea amarilla del sodio, siendo reemplazada por una línea oscura que ocupa precisamente la misma posición que la raya brillante.
Kirchhoff designó este fenómeno con el nombre de inversión del espectro de las llamas, habiéndolo comprobado en un gran número de espectros metálicos. «Si se hace llegar, dice, un rayo solar á través de una llama de litio, se ve aparecer en el espectro, en el sitio de la raya roja, otra oscura que compite en pureza con las rayas de Frauenhofer más características, y que desaparece cuando se retira la llama de litio. No se obtiene tan fácilmente la inversión de las rayas brillantes de los otros metales; sin embargo Bunsen y yo hemos tenido la suerte de invertir las rayas más brillantes del potasio, estroncio, calcio y bario.»
¿Qué consecuencia debe deducirse de este hecho tan singular? Que los vapores metálicos, dotados de la propiedad de emitir en abundancia ciertos rayos de colores con preferencia á los otros, absorben por el contrario estos mismos rayos emanados de un foco luminoso. Por ejemplo, la luz del sodio que emite rayos amarillos de refrangibilidad determinada, absorbe precisamente los rayos amarillos de igual refrangibilidad de la luz Drummond á su paso por ella, resultando de aquí esa raya negra que en el espectro continuo se sitúa en el puesto que ocupaba la raya brillante del sodio.
Si esta absorción es un hecho general, debe deducirse de ella que las líneas negras, observadas en el espectro solar, indican la inversión de otras tantas rayas brillantes debidas á los vapores metálicos de su atmósfera. Esta atmósfera hace con respecto á nosotros las veces de un mechero oscuro de Bunsen, y la viva luz del cuerpo del Sol las de la luz Drummond en el mismo experimento.
Estudiando Bunsen y Kirchhoff bajo este punto de vista las rayas negras del espectro solar, comprobaron la coincidencia de gran número de ellas con las rayas brillantes de ciertos metales. Por ejemplo, las 70 líneas brillantes del hierro, que varían en color, anchura é intensidad, coinciden exactamente con las 70 rayas oscuras del Sol, por lo que es imposible dudar que en la atmósfera solar haya hierro en estado de vapor metálico. Además reconocieron la presencia de diez y nueve cuerpos simples en el Sol: hidrógeno, cobre, zinc, cromo, nikel, magnesio, bario, calcio, sodio, potasio, aluminio, manganeso, cobalto, estroncio, cadmio, titano, cerio, uranio y plomo.
La consecuencia de todo ello es que los procedimientos espectrográficos nos permiten analizar la composición de materiales terrestres que podemos tocar, pero también de las estrellas más lejanas.
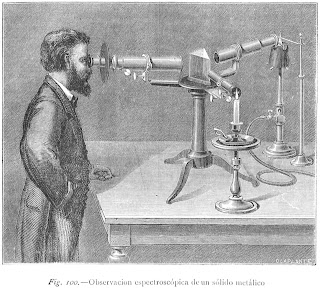
Para estudiar los espectros se utilizaban aparatos llamados espectroscopios.

Dase el nombre de espectroscopios á los instrumentos que sirven para analizar los focos de luz, es decir, para estudiar la composición de los espectros que producen estas luces, cuando son refractadas por un prisma.
En el centro de una plataforma circular horizontal sustentada por un pié está situado verticalmente el prisma P, que por lo regular es de Flint muy puro y su ángulo de 60°. Hay además dos cuerpos de anteojo C y B colocados simétricamente con relación á las caras laterales del prisma y en la posición de la desviación minimum respecto de los haces que los atraviesan y que son refractados por el prisma. El anteojo C lleva en su extremidad más apartada del prisma y en el sitio del ocular una placa metálica con una ranura que se puede ensanchar ó reducir como se quiera. Delante de esta placa A se pone el foco luminoso que se ha de analizar. Los rayos luminosos que atraviesan la ranura pasan paralelamente por un sistema de dos lentes, de suerte que es un haz vertical el que penetra en el prisma, se refracta en él, y al salir va á dar en el objetivo del anteojo B. Aplicando el ojo al ocular de este segundo anteojo puede estudiar el observador el espectro producido por la dispersión.
En E, y delante de un tercer anteojo, D, va adaptada una lámina de cristal en la cual está
trazada una escala micrométrica de divisiones equidistantes muy finas: esta escala se halla colocada horizontalmente y alumbrada por una vela. Se orienta el tubo D de modo que la imágen del micrómetro se reproduzca en la cara lateral del prisma de donde emerge el haz luminoso del foco, y se refleje precisamente en la dirección del eje del anteojo B.
Si, estando todo dispuesto de esta suerte, se aplica el ojo al ocular de B, se percibe con gran claridad, por una parte el espectro del foco que se estudia, con todos sus colores y rayas, y por otra la imagen del micrómetro que, sobreponiéndose á dicho espectro, lo divide por consiguiente en partes equidistantes y numeradas. Así pues, se puede anotar la posición exacta ocupada por tal ó cual color, ó por una raya determinada del espectro observado.
Asimismo es posible comparar directamente las partes de refrangibilidad igual de los espectros de dos focos diferentes. Para esto se fija en la parte superior de la ranura del colimador C un pequeño prisma de cristal de reflexion total, que recibe lateralmente los rayos del segundo foco y los envia al eje de la lente: el haz se dispersa como el del foco colocado delante de la ranura. Entonces, aplicando el observador el ojo al ocular convenientemente graduado, ve los dos espectros dispuestos horizontalmente uno sobre otro, posición que permite reconocer las rayas comunes ó medir la diferencia de refrangibilidad de las rayas vecinas.
Cuando se observa, se tiene cuidado de cubrir el prisma con un tambor ennegrecido interiormente, para impedir el acceso é influencia de cualqier otra luz: este tambor tiene tres orificiops circulares que corresponden a los tres tubos del espectroscopio.
En 3B Scientific disponen de espectroscopios desde 7,54 hasta 2.337 €.En La web de Anilandro podemos encontrar información para construir un sencillo espectroscopio.
En la página de la Universidad de Oregon se pueden consultar los espectros de emisión y absorción de los diferentes elementos químicos de la tabla periódica.



No hay comentarios:
Publicar un comentario